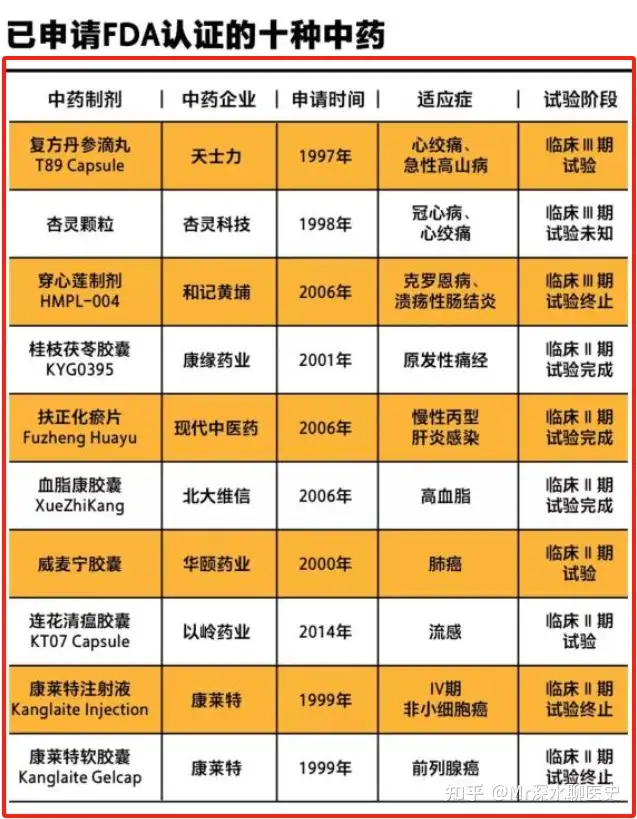
中国赴美FDA申请IND(新药临床试验)的诸多中药里,除了大名鼎鼎的复方丹参滴丸外,还有一款咖位非常牛X的中药注射剂,这就是康莱特注射剂
此前我在介绍康莱特的时候,着眼点最多的还只是它的主要成分——薏米油。毕竟注射剂里直接往血管里注射油脂的并不多,康莱特更是注射剂里少之又少的存在
不过我还从未说过康莱特在美国IND的过程和细节,这里面其实存在着一个我们完全想象不到的,非常大的BUG
我们知道,大部分赴美申请IND的中药,无论是是片剂还是注射剂,但其在对比试验中一般都会采取临床适应症范围内的西药
因为有明确临床适应症对标西药的中成药,大部分情况下都在国内有过多年的临床应用经验,所以普遍认为其通过率要高很多
但对标西药这事儿是个双刃剑
因为你要建立对标标准,那么临床上就有了明确的目标终点。就是说你至少也达到西药这边的临床数据,这才意味着你你可以排除安慰剂效应,且在临床上可以平替对标药物
而大部分中成药IND都倒在了这一关,要么是过不了安慰剂这一关,要么是临床目标重点比不上对标的西药
可唯独康莱特注射剂是个例外
康莱特注射剂在临床上一般用于癌症的治疗,是我们中药里非常罕见的用于治疗癌症的中药注射剂
理论上赴美IND它也会选择一种对标的西药作为参照物,但是……
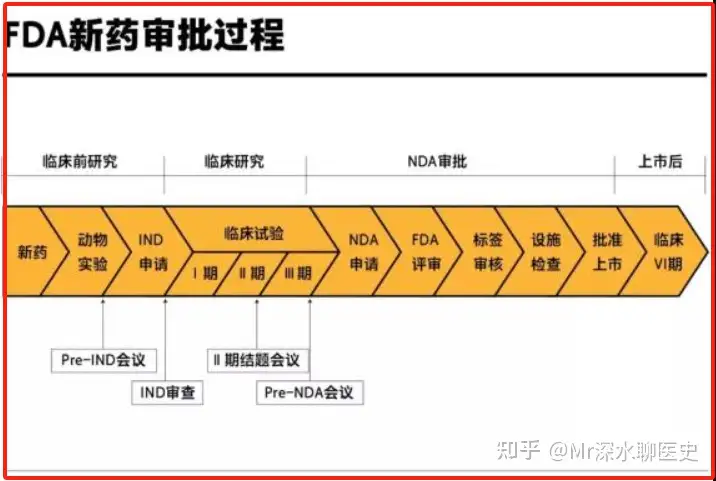
就在康莱特2003年通过FDAⅠ期临川试验,要选择适应症范围时,康莱特竟然选择了胰腺癌作为自己的临床试验适应症
了解点儿癌症的知友都知道,胰腺癌那玩意儿可是号称“癌王”啊,临床上那是最难攻克的病症,甚至连西医西药这边没有特别有效的方法
而之所以康莱特选择胰腺癌,原因正是2003年这个当口,美国还没有任何一款适应症范围包括胰腺癌的对标西药
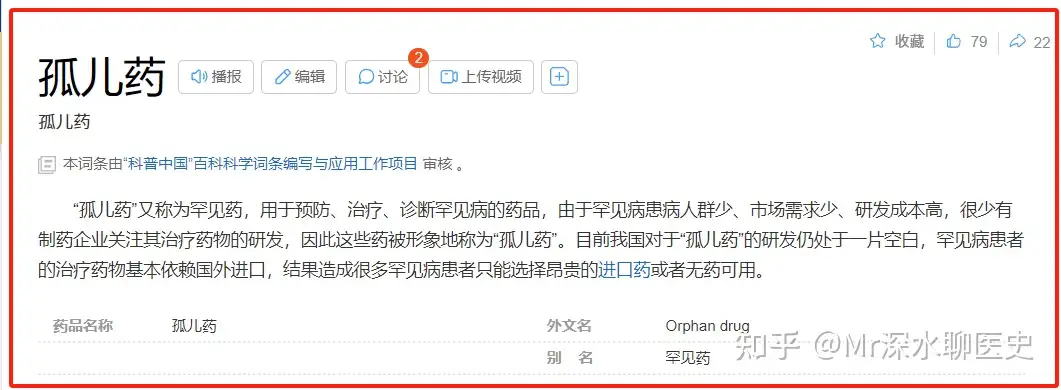
所以康莱特在Ⅱ期临床试验申请的药物类别,竟然号称IND杀手的Orphan Drug
也就是大名鼎鼎的——孤儿药
相对于普通药物的IND,美国FDA对于孤儿药物的审批直接上了两个强度。如果说复方丹参滴丸的IND试验难度是打野,那康莱特一上来就奔着推塔去了
康莱特在赌,因为适应症范围越窄、对标药物越少,意味着赛道还不够卷,通过率就高
但代价就是没有回头路
如果临床试验证明胰腺癌你的治疗效果并不好,或者参与试验人数不够(孤儿药招聘试验对象极其困难),那么你连开展其他临床试验的机会都没有,直接推倒重来
好死不死,康莱特就遇到了第二种情况,他赌失败了
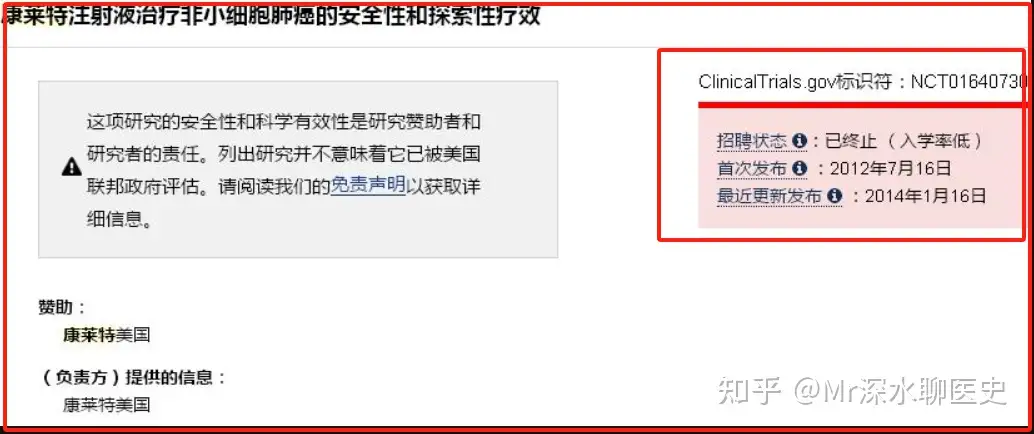
在Ⅱ期试验过程中,为了保险起见康莱特选择了吉西他滨加康莱特注射剂的联合用药试验方法,受试者为胰腺癌确诊、局部浸润或转移患者,有可能行根治性切除手术者除外
结果就是,2005年开展的Ⅱ期临床试验,2008年宣告实验失败,原因是康莱特未能招聘到足够的参与人数
得~一切推倒重来
这也是中药历史上第一次,以“孤儿药”身份闯关FDA,最终遭遇失败。所以自此以后,再也没有第二款中药走“孤儿药”的路,大家宁可卷死,也不愿意承担实验失败然后全部推倒重来的代价
所以康莱特第二次申请IND,就学复方丹参滴丸一样,老老实实的选择了“非小细胞肺癌”这一适应症范围较广的病症来做试验
而推倒重来重新试验,康莱特则花了整整7年,一直到2015年才进入Ⅱ期临床试验
从2003年开始闯关FDA,到2015年第二次进入Ⅱ期临床,康莱特在FDA已经花费了整整12年
那你问了,这二次闯关结果如何呢?
用脚后跟想都能猜到,但凡通过了IND取得了FDA的认可,那咱们整个中医药界那不得疯,新闻联播得用一半时长来给“中药注射剂康莱特闯关FDA成功”这做宣传
2015年康莱特再次进入Ⅱ期IND,到2018年除了安全性试验正常结束外,针对非小细胞肺癌的临床试验再次因为样本量不够直接被终止了
但在对国内的宣传中,康莱特公司掩盖了两项单独用药二期临床试验终止的事实,就直接宣称康莱特注射剂在美进入三期临床试验
这相当于一个人高中刚毕业,获得了考取大学的机会,就直接对外宣传自己是大学生了
那你说康莱特是不是疯了?从2003年一直到2018年整整15年过去了,它在么过FDA两次Ⅱ期临床试验花费海了去了,结果全部失败,这不是糟蹋钱吗?
如果你这么想,就说明你根本不明白中药赴美闯关FDA这件事背后的价值
就在这15年间,康莱特一直利用自己在美国闯关FDA做文章,为自己吸引了庞大的流量和资金支持
康莱特公司的整体营收从2005年的年销售额不到1.2亿,到2014年直接飙升至5.8亿,10年增长近5倍,其中销量额占比最大的就是康莱特注射液,约为94.2%
那句话怎么说来着?
中药……
真的是烂到根儿上了
附:目前在FDA申请认证的中成药,截止到2018年全部失败





















没有回复内容